Minimum DataBase
Caso clinico: Lupin
Linfoma Alimentare

Informazioni generali
Nome: Lupin
Età: 12 anni
Razza: Europeo
Sesso: Maschio castrato
Motivo della visita
Lieve inappetenza, vomito, perdita di peso
Anamnesi:
Da circa un mese appetito capriccioso e da cinque mesi episodi di vomito ingravescente sia dopo il pasto che a stomaco vuoto (con defecazione regolare) e perdita di peso. Nessuna storia di malattia antecedente. Gatto indoor. Mangia alimento secco di buona qualità. Vaccinazioni eseguite regolarmente sulla scorta del risultato del titolo vaccinale.
Esame obiettivo generale
Nessun segno di rilievo. Peso 4,3 Kg (in base alle visite precedenti, si osserva una perdita di peso di circa 200 g.), BCS (5/9).
Piano diagnostico
Considerando che il problema principale è il vomito (la perdita di peso e’ stata probabilmente causata dalla lieve inappetenza, il quale e’ un sintomo aspecifico), si decide di intraprendere un iter diagnostico al fine di investigare cause gastro-enteriche (patologia infiammatoria, neoplasia, intolleranza alimentare, meno probabile corpo estraneo o intussuscezione non ostruttivi, patologie infettive) ed extra gastro-enteriche di vomito (patologia renale cronica, pancreatite, colangite, ipertiroidismo, diabete mellito, per citare le diagnosi differenziali piu’ rilevanti in questo caso). È stato quindi condotto un Minimum Data Base (MDB) comprendente un esame emocromocitometrico, un profilo biochimico ed un’analisi delle urine. Considerata l’età del paziente si include nello screening anche la determinazione del T4 totale (TT4), T4 libera (fT4) ed un esame ecografico completo dell’addome.
Interpretazione dei risultati dei test diagnostici
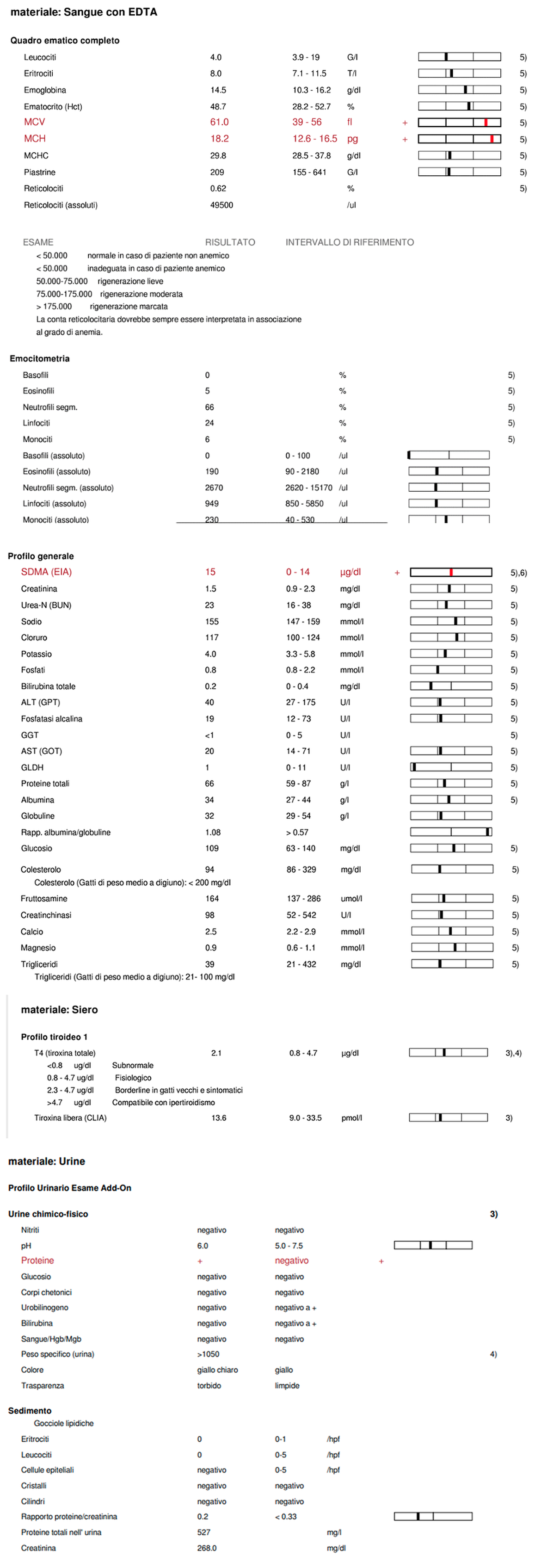
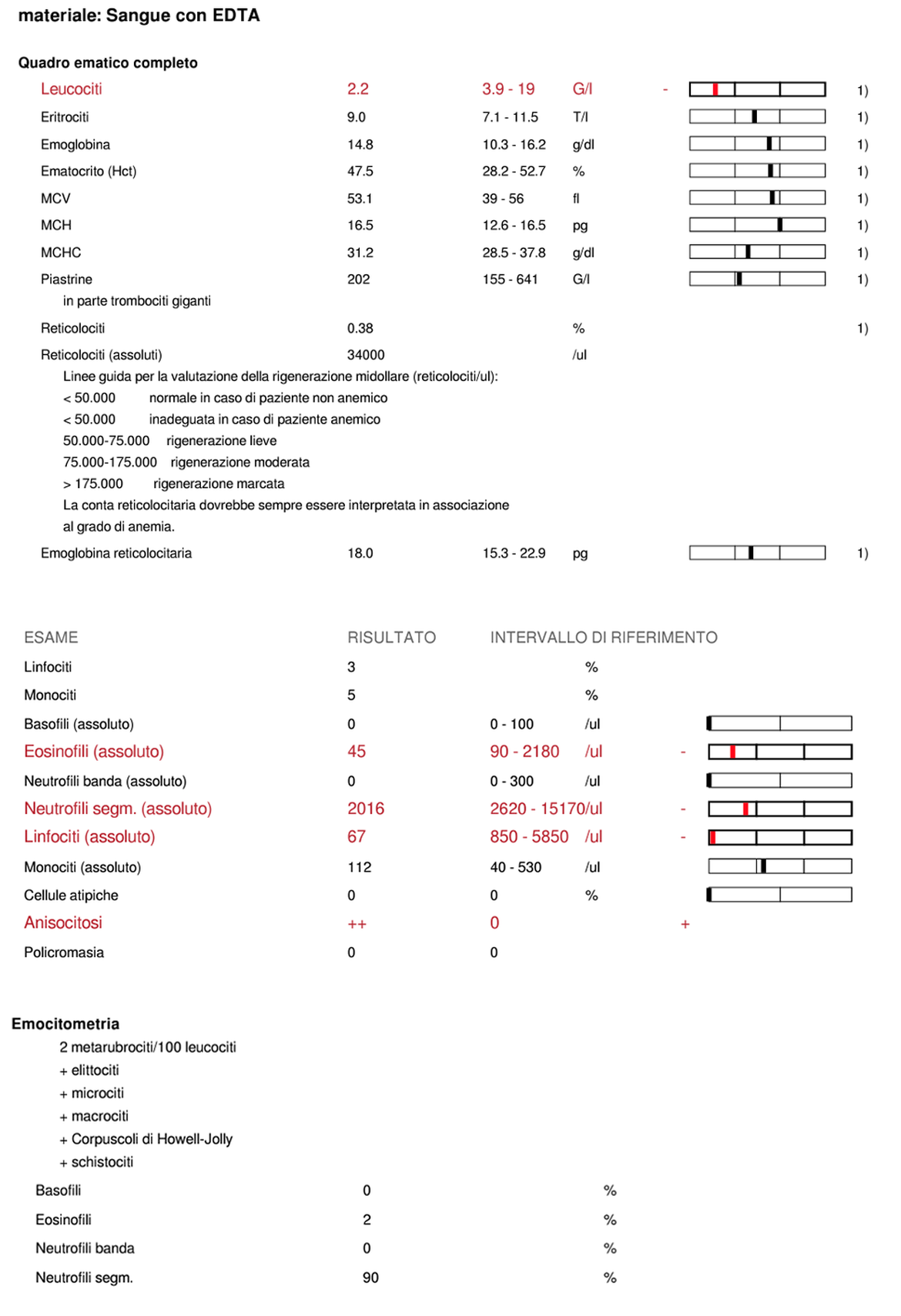
L&rsI risultati degli esami emocromocitometrico e del profilo biochimico non hanno evidenziato alterazioni di rilievo ad eccezione di una macrocitosi e un lieve aumento dell’SDMA. Tra le possibili cause di macrocitosi ricordiamo: la reticolocitosi, artefatti da conservazione in EDTA, carenza di cobalamina, infezione da leucemia virale felina (FeLV). Il lieve aumento dell’SDMA potrebbe indicare un’iniziale riduzione della funzionalità renale. Sia TT4 che fT4 risultano nella norma. L’esame delle urine non evidenzia alterazioni di rilievo.
È stata eseguita una ecografia addominale dalla quale si evidenzia: lieve linfoadenomegalia digiunale, digiuno con parete di spessore nella norma, la parete del duodeno e ileo appare lievemente inspessita in maniera diffusa. Apparato urinario senza alcuna alterazione morfologica degna di rilievo.
Ulteriori valutazioni diagnostiche
È stato eseguito un test rapido FIV/FeLV, data la presenza di macrocitosi, che è risultato negativo.
 Vista l’età del paziente, la sintomatologia ed il reperto ecografico, si opta per eseguire biopsie a tutto spessore di piccolo intestino per via laparotomica, al fine di escludere la presenza di un linfoma intestinale a piccole cellule/enteropatia cronica (CE) che apparivano, al momento, le diagnosi differenziali più probabili. Prima di procedere alla chirurgia, è stato eseguito un profilo coagulativo che è risultato nella norma.
Vista l’età del paziente, la sintomatologia ed il reperto ecografico, si opta per eseguire biopsie a tutto spessore di piccolo intestino per via laparotomica, al fine di escludere la presenza di un linfoma intestinale a piccole cellule/enteropatia cronica (CE) che apparivano, al momento, le diagnosi differenziali più probabili. Prima di procedere alla chirurgia, è stato eseguito un profilo coagulativo che è risultato nella norma.

Sulla base del referto ecografico e dei rilievi ematobiochimici, si esegue un profilo gastroenterico e pancreas che evidenza la lipasi pancreatica specifica e la cobalamina nei range della norma, tuttavia l’aumento dei folati potrebbero essere compatibile con disbiosi intestinale oppure non di particolare significato clinico.

La sezione istologica esaminata del duodeno è rappresentata da mucosa, sottomucosa e tunica muscolare. La mucosa presenta villi di lunghezza da lievemente a moderatamente ridotta con fusione degli stessi, i villi sono rivestiti da epitelio cilindrico alto con aumento dei linfociti intraepiteliali. Le ghiandole mostrano una riduzione della densità da moderata a marcata associata ad una espansione linfocitaria rappresentata da linfociti maturi con occasionali plasmacellule. Si apprezza un moderato infiltrato linfocitario anche a livello della sottomucosa. Non si osservano alterazioni morfologiche significative a livello di tunica muscolare. Le alterazioni descritte sopra sono compatibili con linfoma alimentare mucosale a piccole cellule. Mentre nei restanti distretti gastrointestinali esaminati (digiuno ed ileo), le lesioni sono borderline tra una forma infiammatoria, inclusa CE ed un linfoma alimentare a piccole cellule. Vista la presenza di un linfoma a piccole cellule a livello duodenale, i proprietari optano per non eseguire uno studio di clonalità mediante l’esame PARR sul tessuto digiunale ed ileale.
Si esegue inoltre un esame immunoistochimico sul tessuto duodenale, al fine di definire l’immunofenotipo (T o B) della neoplasia. I risultati immunoistochimici ottenuti risultano indicativi di un linfoma ad immunofenotipo T.
Per concludere la stadiazione si eseguono radiografie toraciche in 3 proiezioni (che non evidenziano alcun rilievo degno di nota) ed aspirati ecoguidati di milza e fegato. L’esame citologico identifica una milza nei limiti della norma con ematopoiesi extramidollare ed una lieve degenerazione epatocellulare aspecifica.
Diagnosi e piano terapeutico
La diagnosi finale per Lupin è di linfoma alimentare mucosale a piccole cellule, ad immunofenotipo T.
È stata quindi impostata terapia con prednisone a 2 mg/kg e clorambucile 2 mg/gatto PO a giorni alterni. Dopo 1 mese, la terapia steroidea è stata ridotta a 1 mg/kg e infine mantenuta a 0.5 mg/kg a giorni alterni per ulteriori 5 mesi.
Follow up
Il paziente ha risposto molto bene alla terapia medica con risoluzione degli episodi di vomito, ripresa dell’appetito ed incremento ponderale.
I controlli ematologici eseguiti inizialmente ogni settimana e poi ogni due hanno evidenziato, a distanza di due mesi dall’inizio della terapia, una tossicità ematologica con mielosoppressione associata a neutropenia di I grado risoltasi dopo sospensione del clorambucile per due settimane. I controlli ecografici a distanza di 8 mesi dall’inizio della terapia sono risultati negativi.
Commenti
Il caso qui discusso evidenzia come, anche in assenza di importanti alterazioni ecografiche, ma in presenza di segni clinici gastroenterici cronici in pazienti adulti ed anziani sia importante eseguire indagini bioptiche al fine di poter ottenere una corretta diagnosi e poter così impostare una corretta terapia e stabilire una prognosi per il nostro paziente.
Il linfoma è un’espansione clonale di linfociti neoplastici negli organi solidi ed è la neoplasia più comune nei felini. I gatti di razza siamese sono stati segnalati come razza con un aumentato rischio, tuttavia si può verificare nella maggior parte dei gatti comuni europei. Sebbene il linfoma possa verificarsi nei gatti di qualsiasi età, è principalmente una malattia dei gatti anziani con una media tra i 10 e 13 anni.
Anatomicamente il linfoma alimentare è quattro volte più probabile che si sviluppi nel piccolo intestino piuttosto che nel grosso. La maggior parte dei linfomi gastrointestinali felini può essere classificata in uno dei tre tipi in base all’istopatologia e all’immunoistopatologia: linfoma alimentare di basso grado (LGAL), linfoma alimentare di grado intermedio/alto (I/HGAL) e linfoma a cellule granulari (LGL). I linfomi intestinali del gatto sono stati classificati come mucosali (quando l’infiltrato è confinato all’epitelio e alla lamina propria con estensione minima alla sottomucosa) o transmurali (infiltrato che si estende notevolmente alla sottomucosa e alla muscolare propria).
Il linfoma intestinale a piccole cellule del gatto molto spesso si presenta con sintomi aspecifici quali vomito e/o diarrea (70%-90%), perdita di peso (>80%), o anche con sintomi molto lievi come parziale anoressia (> 50%). I segni clinici generalmente sono cronici (> 1 mese) e sono presenti per molti mesi prima che si giunga a diagnosi (anche 6 mesi).
La palpazione addominale è spesso insignificante in quanto lo spessore della parete intestinale è normale o lievemente aumentato in maniera diffusa con conservazione della stratificazione della parete. In contrasto, la palpazione di una massa intestinale è molto comune nei gatti con HGAL (High-Grade Alimentary Lymphoma) o LGLL (Large Granular Lymphoma). La linfoadenopatia mesenterica è riportata dal 45% all’80 % dei pazienti affetti da LGAL.
È importante sottolineare che le caratteristiche ecografiche di LGAL (Low-Grade Alimentary Lymphoma) non permettono di distinguerlo da CE/enteropatia proteino disperdente (PLE) , le quali rappresentano le maggiori diagnosi differenziali. L’ispessimento dello strato muscolare propria che è risultato essere significativamente associato a LGAL (e non PLE) può aiutare nella diagnosi differenziale. Va comunque sottolineato che il riscontro di uno spessore normale della parete intestinale e/o assenza di linfoadenomegalia non permettono di escludere una diagnosi di LGAL. Quindi nei pazienti con segni clinici coerenti con la malattia è indispensabile eseguire una biopsia intestinale (endoscopica o chirurgica).
La prognosi per questi tipi di linfomi è buona con una risoluzione dei sintomi clinici nell’80% dei casi ed un tempo di sopravvivenza medio che va da 1,5 a 3 anni.
Riferimenti bibliografici:
- Barrs VR, Beatty JA: Feline alimentary lymphoma: 1. Classification, risk factors, clinical signs and non-invasive diagnostics, J Feline Med Surg 14:182–190, 2012
- Ettinger SN. Principles of treatment for feline lymphoma. Clin Tech Small Anim Pract. 2003; 18:98–102.
- Fuentes LV, Abbott J, Chetboul V, Côté E, Fox PR, Häggström J, Kittleson MD, Schober K, Stern JA. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med. 2020 May;34(3):1062-1077
- Kiselow MA, Rassnick KM, McDonough SP, et al.: Outcome of cats with low-grade lymphocytic lymphoma: 41 cases (1995-2005), J Am Vet Med Assoc 232:405–410, 2008.
- Kiupel, M., Smedley, R. C., Pfent, C., et al. (2011) Diagnostic algorithm to differentiate lymphoma from inflammation in feline small intestinal biopsy samples. Veterinary Pathology 48, 212 – 222
- Lingard AE, Briscoe K, Beatty JA, et al.: Low-grade alimentary lymphoma: clinicopathological findings and response to treatment in 17 cases, J Feline Med Surg 11:692–700, 2009.
- Moore PF, Rodriguez-Bertos A, Kass PH: Feline gastrointestinal lymphoma: mucosal architecture, immunophenotype, and molecular clonality, Vet Pathol 49:658–668, 2012.
- Rissetto KVJ, Selting KA, et al.: Recent trends in feline intestinal neoplasia: an epidemiologic study of 1,129 cases in the veterinary medical database from 1964 to 2004, J Am Anim Hosp Assoc 47:28–36, 2011.